螺桨烷...
烃
三环有机化合物共价键反向四面体构型螺旋桨Hunsdiecker反应丁基锂偶联反应柱色谱法卡宾甲基锂去质子作用亲核取代反应异构化乙酸环丁烷千焦摩尔棒烷单体甲酸甲酯过氧化苯甲酰自由基聚合反应低聚物丁基锂阴离子加成聚合反应X射线衍射立方烷菲利普·伊顿Wolff重排反应半衰期氨基化合物氢化铝锂四氢呋喃锂丙烯腈玻璃转化温度°C

一些螺桨烷,从左到右依次为:[1.1.1]螺桨烷,[2.2.2]螺桨烷,1,3-去氢金刚烷
螺桨烷是一类三环有机化合物,三个环共用一个碳碳共价键。它们的特征包括:有碳为反向四面体构型、空间张力很大以及反应活性很高,因此在有机化学中被广泛研究。此类化合物是因为其形状类似螺旋桨而得名。
最简单的螺桨烷是[1.1.1]螺桨烷(C5H6)和[2.2.2]螺桨烷(C8H12)。1,3-去氢金刚烷既是金刚烷家族中的一员,也是[1.3.3]螺桨烷。
目录
1 [1.1.1]螺桨烷
1.1 聚合
2 [2.2.2]螺桨烷
3 1,3-去氢金刚烷
3.1 聚合
4 另見
5 参考文献
[1.1.1]螺桨烷
1982年,人们首次成功合成[1.1.1]螺桨烷[1]。合成办法是首先将二环[1.1.1]戊烷中的1,3-二羧酸1通过Hunsdiecker反应转化为对应的二溴化合物2,接下来在丁基锂的存在下,发生偶联反应。最后产物在-30°C下,通过柱色谱法分离提纯。如图一所示:
![图一:合成[1.1.1]螺桨烷](http://upload.wikimedia.org/wikipedia/commons/thumb/7/78/111propellaneSynthesis.png/400px-111propellaneSynthesis.png)
另外一个合成方法是将一个二溴卡宾加到3-氯-2-氯甲基丙烯6的双键上,在甲基锂的作用下,中间产物7发生去质子作用和亲核取代反应,生成[1.1.1]螺桨烷。[2] 生成物仅能在−196°C存在于溶液中。
螺桨烷的不稳定性是由于它可以在114°C受热异构化生成3-亚甲基环丁烯5,半衰期仅有5分钟。它也可以自发的与乙酸反应,生成环丁烷4。
环张力估计为427千焦/摩尔。
聚合
[1.1.1]螺桨烷是棒烷的单体。[3] 由甲酸甲酯和过氧化苯甲酰引发的自由基聚合反应通常得到低聚物,如图二所示。而由丁基锂引发的阴离子加成聚合反应能得到真正意义上的高聚物。通过X射线衍射证明,聚合物中的C-C键只有一种键长,即148pm。

[2.2.2]螺桨烷
1973年,在成功合成[1.1.1]螺桨烷之前,由合成立方烷而著名的菲利普·伊顿小组已经成功合成了[2.2.2]螺桨烷[4]
其合成路径(图三)使用了两次Wolff重排反应。
![图三:合成[2.2.2]螺桨烷](http://upload.wikimedia.org/wikipedia/commons/thumb/c/cb/222propellaneSynthesis.png/400px-222propellaneSynthesis.png)
这个螺桨烷也不稳定,室温下在溶液中的半衰期为28分钟,异构化生成单环氨基化合物11。其环张力估计为390千焦/摩尔。
1,3-去氢金刚烷
1,3-去氢金刚烷或称四环[3.3.1.13,7.01,3]癸烷是一个金刚烷家族中的[1.3.3]螺桨烷,可以通过氧化1,3-二卤金刚烷制备。[5]。与其他小螺桨烷一样,1,3-去氢金刚烷也不稳定。在溶液中能与空气中的氧发生反应,生成一个过氧化物,半衰期为6小时。后者和氢化铝锂反应生成一个二羟基化合物。

聚合
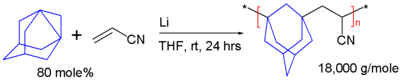
正如其他螺桨烷,去氢金刚烷也能够聚合。如图五所示,在四氢呋喃中,由金属锂引发,它与丙烯腈通过自由基聚合链式反应生成一个共聚物,其玻璃转化温度为217°C[6]
另見
- 名稱獨特的化學物質列表
参考文献
^ [1.1.1]Propellane Kenneth B. Wiberg and Frederick H. Walker J. Am. Chem. Soc.; 1982; 104(19) pp 5239 - 5240; doi:10.1021/ja00383a046.
^ Organic Syntheses, Coll. Vol. 10, p.658 (2004); Vol. 75, p.98 (1998) Online article.
^ [n]Staffanes: a molecular-size "Tinkertoy" construction set for nanotechnology. Preparation of end-functionalized telomers and a polymer of [1.1.1]propellane Piotr Kaszynski and Josef Michl J. Am. Chem. Soc.; 1988; 110(15) pp 5225 - 5226; doi:10.1021/ja00223a070
^ [2.2.2]Propellane system Philip E. Eaton and George H. Temme J. Am. Chem. Soc.; 1973; 95(22) pp 7508 - 7510; doi:10.1021/ja00803a052
^ Tetracyclo[3.3.1.13,7.01,3]decane. Highly reactive 1,3-dehydro derivative of adamantane Richard E. Pincock and Edward J. Torupka J. Am. Chem. Soc.; 1969; 91(16) pp 4593 - 4593; doi:10.1021/ja01044a072
^ Formation of Alternating Copolymers via Spontaneous Copolymerization of 1,3-Dehydroadamantane with Electron-Deficient Vinyl Monomers Shin-ichi Matsuoka, Naoto Ogiwara, and Takashi Ishizone J. Am. Chem. Soc.; 2006; 128(27) pp 8708 - 8709; (Communication) doi:10.1021/ja062157i